研究内容
臓器間ネットワークによる膵β細胞制御
血糖値はある一定の幅の中で精緻に調節されています。その調節機構を維持するためには、インスリンを分泌する膵β細胞の数の制御が重要です。我々は以前この観点から研究を進め、個体内でインスリン産生細胞を増やすことを目的として、肝臓への遺伝子導入を行うことによりin vivoの肝臓でインスリン産生細胞を作成することに成功しました[1]。
膵β細胞の数が増加する代表的な例として、肥満の状態があげられます。肥満状態ではインスリン標的臓器におけるシグナル伝達が抑制されます(インスリン抵抗性)が、インスリン抵抗性の際には、膵β細胞が増加しインスリン分泌を亢進する、代償性膵β細胞反応を起こすことでそれを補填し、糖尿病の発症は予防されます。この仕組みは、「体に備わった抗糖尿病機構」と考えられます。日本人は欧米人と比較して、この機構の働きが弱いことも指摘されており、このことは肥満度が少ないにも関わらず、日本において糖尿病患者が増加している要因と考えられます。一方、1型糖尿病は膵β細胞数の絶対的な不足による高血糖を呈する疾患ですが、その根治には膵β細胞数を増やすことが必要です。しかし現状の医療においては、残念ながらその実現には至っていません。この「体内に備わっている膵β細胞を増加させる機構」を解明することは、糖代謝の恒常性維持の解明に重要な課題であるとともに、糖尿病の様々な病態の治療法開発にもつながることが期待されます。しかし、何がきっかけで膵β細胞が増加し始めるのか、については不明な点が多く存在します。実際に肥満モデルマウスにおいては高血糖を呈する以前から膵島の肥大を呈すること、耐糖能が正常の肥満者においても、高インスリン血症を呈することなどが報告されており、血糖値の上昇、ということ以外に、代償性膵β細胞反応を引き起こすいまだ未知の因子の存在が想定されます。このメカニズムを解明することで、体内のあるべき場所(膵ランゲルハンス島)で膵β細胞の数を増やすという画期的な糖尿病の再生治療につなげようと考えています。
我々は以前、交感神経によって脂肪組織でのアディポネクチン産生が制御されていること[2]を報告するなど、自律神経による代謝制御機構に着目していました。このような背景から研究を進め、個体において肥満状態を感知した肝臓から肝臓-内臓神経求心路-中枢神経-迷走神経遠心路-膵β細胞という神経ネットワークを介して膵β細胞が増加を始めるシグナルが伝達されていること(図1)、これが肥満状態での膵β細胞数増加にも関与していることを世界で初めて見出し、Science誌に発表しました(図2)。さらにインスリン欠乏性糖尿病モデルマウスにおいて、この臓器間ネットワークを”ON”にすることによって膵β細胞が再生し、糖尿病が治療できる (図2 右上)ことも明らかにしました [3, 4]。現在このシステムの詳細な分子機構を明らかにする研究に取り組んでいます。これにより個体としての糖代謝調節機構の解明と、これまでにない視点からの糖尿病の根治治療の開発につなげることを目指しています。
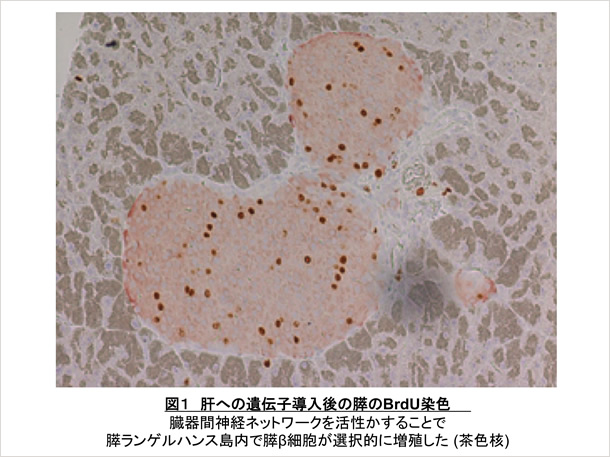
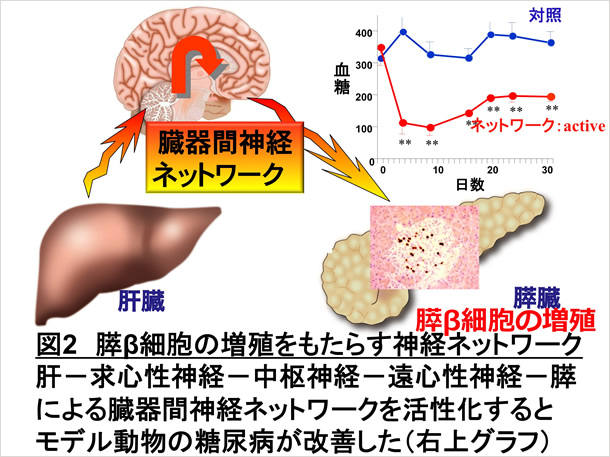
さらに、これらの結果は体内に備わったシステム、特に、神経による臓器間ネットワークを”ON”にするという手法により、in vivoにおいて、損傷を受けた臓器・組織を再生させうることを意味し、全く新しい観点からの再生医療の発展につながることが期待され、膵β細胞のみならず、神経シグナルによる様々な臓器再生に着目した研究をも進めています。
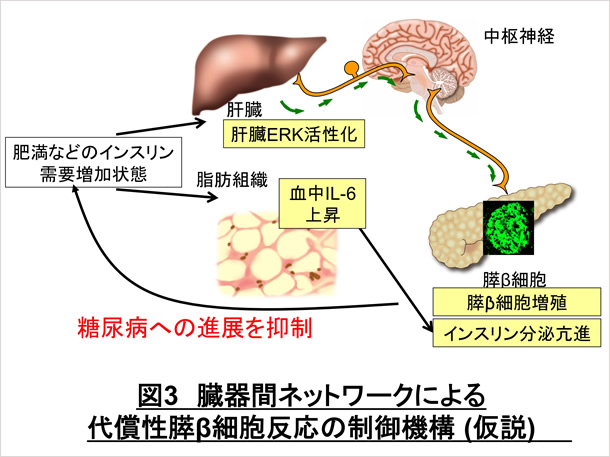
一方我々は、肥満に伴い血中で増加するIL-6が膵β細胞からのインスリン分泌を亢進することを見出しました[5]。IL-6は肥満が形成される際に早期から血中で上昇することが知られています。このことからIL-6による膵β細胞からのインスリン分泌亢進は肥満の際の代償性膵β細胞反応としての高インスリン血症を形成する機序の一つと考えられます。これは、肥満の早期、血糖値の上昇以前からインスリンの分泌を亢進することにより、その後の血糖値の上昇を抑制する、つまり糖代謝の恒常性を維持する内因性の抗糖尿病機構の一つなのではないかと考えています(図3)。我々は、他臓器と膵β細胞間の臓期間ネットワークによる代償性膵β細胞反応の制御機構が他にもあるのではないかと考えその探索も行いたいと考えています。
また我々は以前、インスリン受容体抗体が産生されることによって著明なインスリン抵抗性を呈する難治性の自己免疫疾患であるB型インスリン抵抗症に対して、Helicobacter Pyloriの除菌が有効な治療法となる可能性を世界で初めて示しLancet誌に報告しました[6]。今後も臨床医としての観点からの研究や症例報告を積極的に世界に向けて発信していきたいと考えています。
■ Reference
- Imai, J., et al., Constitutively active PDX1 induced efficient insulin production in adult murine liver. Biochem Biophys Res Commun, 2005. 326(2): p. 402-9.
- Imai, J., et al., Cold exposure suppresses serum adiponectin levels through sympathetic nerve activation in mice. Obesity (Silver Spring), 2006. 14(7): p. 1132-41.
- Imai, J., et al., Regulation of Pancreatic {beta} Cell Mass by Neuronal Signals from the Liver. Science, 2008. 322(5905): p. 1250-1254.
- Imai, J., Y. Oka, and H. Katagiri, Identification of a novel mechanism regulating beta-cell mass: neuronal relay from the liver to pancreatic beta-cells. Islets, 2009. 1(1): p. 75-7.
- Suzuki, T., et al., Interleukin-6 enhances glucose-stimulated insulin secretion from pancreatic beta-cells: potential involvement of the PLC-IP3-dependent pathway. Diabetes, 2011. 60(2): p. 537-47.
- Imai, J., et al., Eradication of insulin resistance. Lancet, 2009. 374(9685): p. 264.


