研究内容
エネルギー代謝調節を中心とした
臓器間神経ネットワーク
人体は、約60兆個、270種類以上の細胞によって形成されていると言われています。そして、種々の細胞は多様な組み合わせよって臓器/組織を形成し、個体を成立させています。臓器/組織は、構成要素である細胞が糖質、脂質、蛋白質などの栄養素をエネルギー源として活用し機能することで、生命活動の維持に寄与しています。一方、閉鎖空間である個体において利用できるエネルギー量は有限であり、個体レベルでのエネルギー代謝調節が適切になされることが、個々の臓器/組織、ひいては細胞が円滑に機能する為に重要です。その調節に、臓器間ネットワークが必須の役割を担っていることが示されてきました。古くは、クロード・ベルナール(実験医学序説の著者)が、個体レベルの糖代謝調節が神経支配のもとにあることを示唆しましたが、その後、インスリンやグルカゴンなどホルモンの発見が相次ぎ、臓器間ネットワーク研究は内分泌系において飛躍的に進展しました。一方、我々の研究成果を含め、近年の研究の進歩により、自律神経を介した臓器間ネットワークの重要性が再認識されてきています(図1)。
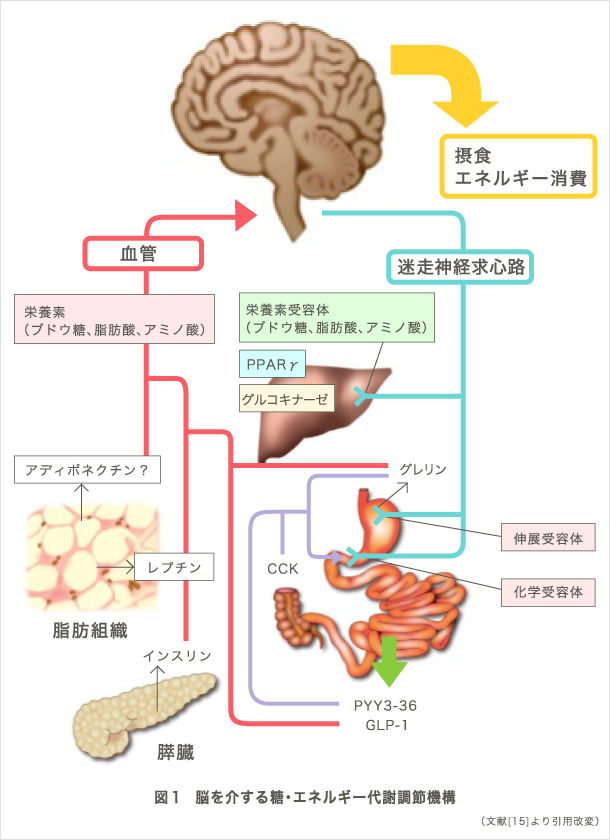
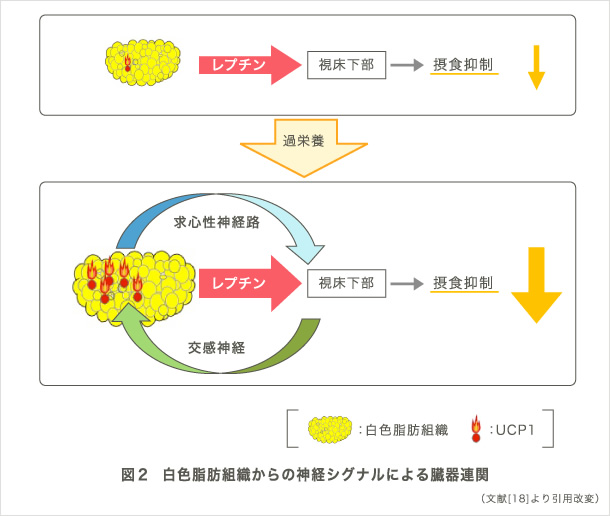
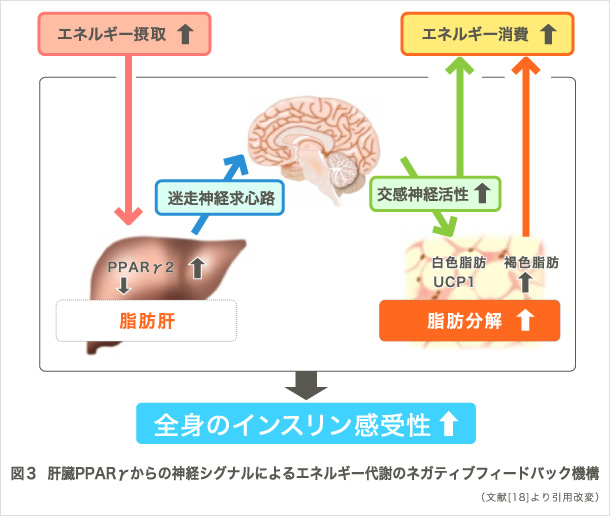
我々の研究グループでは、2型糖尿病、メタボリックシンドロームなどの代謝性疾患を対象とし、個体レベルでの病態解明を目指して研究を進めてきました。例えば、内臓脂肪組織でのエネルギー消費亢進によって発信されるシグナルが、糖尿病を改善することや求心性神経線維を介して食欲を抑制することを発見しました(図2)(1)。この研究成果は、同号のfeatured preview (2)やNature誌の総説 (3)でも大きく取り上げられました。さらに、過栄養時に肝臓のPPARγが発信する求心性神経シグナルが、エネルギー消費の亢進をもたらし、体重の恒常性維持や糖尿病の改善に寄与することを見出しました(図3)(4)。この成果もCell Metabolism誌でpreview (5)として紹介され注目を集めました。加えて、生理的な交感神経系の活性化が血清アディポネクチン濃度を減少させること(6)、糖尿病・肥満が中枢神経の体内時計を変調させること(7)、心理的ストレスが視床下部-下垂体-副腎系介して肝代謝の日内リズムを変調させること(8)、などを世界に先駆けて報告してきました。
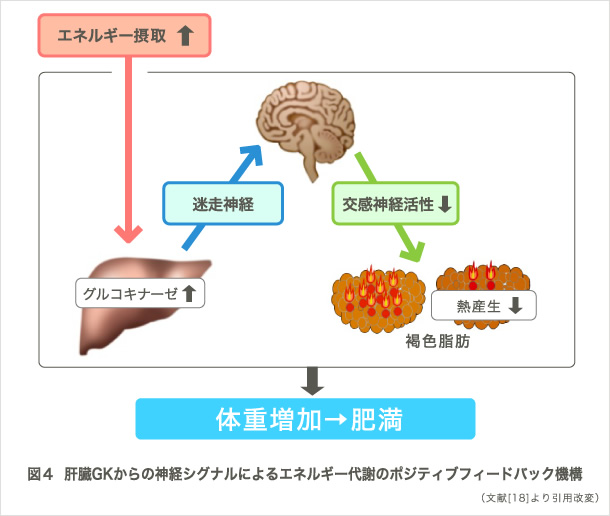
最近では、これまでの研究経験を生かして、個体レベルでのエネルギー備蓄機構を司る新たな臓器間神経ネットワークを見出しました(9)。この研究は、過栄養摂取による肝臓での糖代謝亢進が、褐色脂肪組織でのエネルギー消費を抑制することにより、エネルギー備蓄につながるという、肝から褐色脂肪への臓器間神経ネットワークを解明したものです(図4)。さらに、脳の種々の部位を解析することで、この臓器間神経ネットワークにおける脳の役割を解明し、肥満につながるメカニズムのひとつを解き明かしました。従来、体重の増加は恒常性維持機構の破綻が要因であると考えられてきました。今回、末梢の代謝変化に応じて脳が代謝情報を統御し、能動的にエネルギー備蓄(=体重増加)を行う役割を担っていることを示した成果は、飢餓を乗り越えて種を保存してきた哺乳類に備わっている根源的な仕組みを明らかにしたものとして、生物学的にも興味深いものと考えています(10)。また、飽食の現代において、肥満人口が爆発的に増えている本質的な理由を明らかにするとともに、糖尿病・肥満・メタボリックシンドロームといった疾患の根源的な治療法の開発につながり得ることから、医学的側面からも大きな意義があります。
はじめに述べましたように、ヒトを初めとする多臓器生物では、体重や血糖値も一つの臓器だけで決まるものではなく、全身の臓器連関によって成り立っています。我々は、糖尿病や代謝疾患を専門とする内科医の視点から(11-14)、独創的な研究を行うことで、生命現象を個体レベルで明らかにし、医学の進歩に貢献することを目標としています。
*参考総説:(15)、(16)、(17)、(18)
■ 文献
- Yamada T*, Katagiri H*, Ishigaki Y*(*co-first author), Ogihara T, Imai J, Uno K, Hasegawa Y, Gao J, Ishihara H, Niijima A, Mano H, Aburatani H, Asano T, Oka Y. Signals from intra-abdominal fat modulate insulin and leptin sensitivity through different mechanisms: neuronal involvement in food-intake regulation. Cell Metab. 3(3):223-9, 2006.
- Unger, R.H. and J.K. Elmquist, Movin' on up: adipocytes become regulators of nutrient homeostasis. Cell Metab, 3(3): p. 147-8, 2006.
- Rosen, E.D. and B.M. Spiegelman, Adipocytes as regulators of energy balance and glucose homeostasis. Nature, 444(7121): p. 847-53, 2006.
- Uno K*, Katagiri H*, Yamada T*(*co-first author), Ishigaki Y, Ogihara T, Imai J, Hasegawa Y, Gao J, Kaneko K, Iwasaki H, Ishihara H, Sasano H, Inukai K, Mizuguchi H, Asano T, Shiota M, Nakazato M, Oka Y. Neuronal pathway from the liver modulates energy expenditure and systemic insulin sensitivity. Science. 312(5780):1656-9, 2006.
- Schwartz, G.J., Dirty dealing: hepatic vagal afferents reshuffle fat distribution. Cell Metab, 4(2): p. 103-5, 2006.
- Imai J*, Katagiri H*, Yamada T*(*co-first author), Ishigaki Y, Ogihara T, Uno K, Hasegawa Y, Gao J, Ishihara H, Sasano H, Oka Y. Cold exposure suppresses serum adiponectin levels through sympathetic nerve activation in mice. Obesity (Silver Spring). 14(7):1132-41, 2006.
- Kaneko K*, Yamada T* (*co-first author), Tsukita S, Takahashi K, Ishigaki Y, Oka Y, Katagiri H. Obesity alters circadian expressions of molecular clock genes in the brainstem. Brain Res. 1263:58-68, 2009
- Takahashi K, Yamada T (corresponding author), Tsukita S, Kaneko K, Shirai Y, Munakata Y, Ishigaki Y, Imai J, Uno K, Hasegawa Y, Sawada S, Oka Y, Katagiri H. Chronic mild stress alters circadian expressions of molecular clock genes in the liver. Am J Physiol Endocrinol Metab 304(3):E301-9. 2013
- Tsukita S, Yamada T (corresponding author), Uno K, Takahashi1 K, Kaneko K, Ishigaki Y, Imai J, Hasegawa Y, Sawada S, Ishihara H, Oka Y, Katagiri H. Hepatic glucokinase modulates obesity predisposition by regulating BAT thermogenesis via neural signals. Cell Metab. 16(6):825-32. 2012
- Yamada T (corresponding author), Tsukita S, Katagiri H. Identification of a novel inter-organ mechanism favoring energy storage in over-nutrition. Adipocyte. 2(4):281-284. 2013
- Yamada T, Imai J, Ishigaki Y, Hinokio Y, Oka Y, Katagiri H. Possible relevance of HLA-DRB1*0403 haplotype in insulin autoimmune syndrome induced by alpha-lipoic acid, used as a dietary supplement. Diabetes Care. 30(12):e131, 2007
- Ogihara T, Katagiri H, Yamada T, Kudo H, Imai J, Ishigaki Y, Hinokio Y, Yamagiwa Y, Ueno Y, Shimosegawa T, Oka Y. Peginterferon (PEG-IFN) plus ribavirin combination therapy, but neither interferon nor PGE-IFN alone, induced type 1 diabetes in a patient with chronic hepatitis C. Intern Med. 48(16):1387-90, 2009
- Imai J*, Yamada T*(*co-first author), Saito T, Ishigaki Y, Hinokio Y, Oka Y, Katagiri H. Eradication of insulin resistance. Lancet. 374(9685):264, 2009
- Munakata Y, Yamada T (corresponding author), Takahashi K, Tsukita S, Takahashi K, Sawada S, Imai J, Ishigaki Y, Oka Y, Katagiri H. A case of slowly progressive type 1 diabetes with insulin independence maintained for 10 years with α-glucosidase inhibitor monotherapy. Intern Med. 51(24):3391-4.2012
- Yamada T, Katagiri H. Avenues of Communication between the Brain and Tissues/Organs Involved in Energy Homeostasis. (Review) Endocr J. 54(4):497-505, 2007
- Katagiri H, Yamada T, Oka Y. Adiposity and cardiovascular disorders: disturbance of the regulatory system consisting of humoral and neuronal signals. (Review) Circ Res. 101(1):27-39, 2007
- Yamada T, Oka Y, Katagiri H. Inter-organ metabolic communication involved in energy homeostasis: Potential therapeutic targets for obesity and metabolic syndrome. (Review) Pharmacol Ther. 117(1):188-98, 2008
- Yamada T. Inter-organ communications mediate crosstalk between glucose and energy metabolism. (Review) Diabetol Int. 4(3):149-155. 2013


